个人防护口罩
个人防护口罩需通过NIOSH注册,企业直接在NIOSH申请。按照NIOSH认证标准,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系部分资料)至NIOSH文审,文审和测试都通过后,NIOSH核发批文
医用口罩
美国医用N95 医用口罩需通过FDA注册,企业直接向FDA申请并提交相关材料。
此外还有两种可选途径:
(1)已经获得NIOSH注册的N95口罩,在产品生物学测试、阻燃测试和血液穿透测试通过的情况下,可以豁免产品上市登记(510K),直接进行FDA工厂注册和医疗器械列名。
(2)如果获得持有510K的制造商的授权,可以作为其代工厂使用其510K批准号进行企业注册和器械列名。
注1:“510(k)”又称上市前登记,是向FDA提交的上市前报告。根据FDA的要求,少数 I 类和大部分II类医疗器械在美国上市前,至少需要提前90天递交510(k)申请
FDA510(k)认证费用:
2020年 FDA510(k)使用费
公司注册年费:5236美元。
对于小型机构、企业或团体,没有豁免或减免——所有机构都必须支付机构注册费。
认证变化
3月28日,美国食品药品管理局FDA又推出了一个新的“紧急使用管理”(Emergency-Use-Administration, 简称EUA),FDA紧急批准了获得了五个国家和欧盟认证的非N95口罩,中国的KN95口罩却不在名单内。
美国接受澳大利亚、巴西、欧盟、日本、韩国、墨西哥本国或地区N95级别的标准,中国的口罩一定要达到NOISH-N95的标准和认证才能在美国使用。
咨询服务机构
UL公司UL中国
E-mail: customerservice.cn@ul.com
三.日本 标准和认证程序
非医用口罩标准
JIS T 8151:2018 防颗粒呼吸器
颗粒过滤效率指标

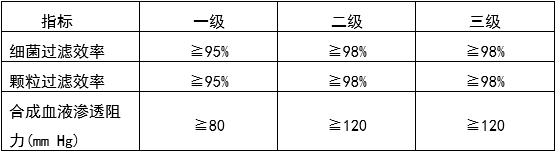
医用口罩标准
ASTM F2100-19 医用口罩材料技术规范
性能指标
认证程序
日本PMDA注册
PMDA(药品和医疗设备代理机构)是日本的监管机构,与厚生劳动省合作。
职责是通过确保药品和医疗设备的安全性,功效和质量来保护公众健康。该机构负责对药品和医疗器械的上市授权申请进行科学审查,监控其上市后的安全性,以及为药物不良反应和药物或生物制品感染的患者提供救济补偿。
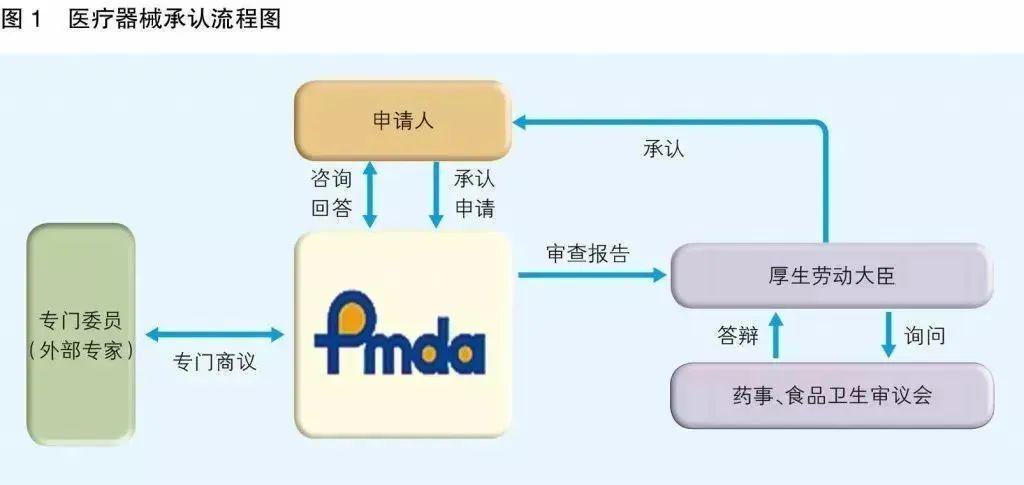
1. 准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方);
2. 制造商向PMDA注册工厂;
3. II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书;
4. 申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。
四.韩国 标准和认证程序
KS M 6673:2008 防颗粒呼吸器
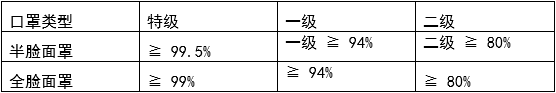
呼吸器标准
法规 MFDS notice No.2015-69
颗粒 过滤效率指标

韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址、www.kpta.or.kr。
韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理,是主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。
KFDA注册流程为:
1. 确定产品分类(I,II,III,IV),选择KLH(韩国持证方);
2. II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的贝斯通检测贝斯通检测第三方审核员,并获得KGMP证书;
3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;
4. 由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批;
7. 指定韩国代理商和经销商,产品销售
五.澳大利亚 标准和认证程序
AS/NZ 1716:2012 防颗粒呼吸器
更多详情联系贝斯通检测技术深圳有限公司












评论前必须登录!
注册